بررسی اجمالیبخش دیگر
گلیکوزیلاسیون فرآیند افزودن بقایای قند به پروتئین ها و لیپیدها در مسیرهای مختلف سلولی است. اختلالات مادرزادی گلیکوزیلاسیون (CDG) یک گروه ناهمگن ژنتیکی و بالینی متشکل از صدها بیماری است که به دلیل نقص در مراحل مختلف در طول مسیرهای سنتز یا اصلاح گلیکان ایجاد می شود. بیشتر این بیماریهای تکوژنیک از نظر توارث اتوزومال مغلوب هستند، اما اشکال اتوزومال غالب و مرتبط با X نیز توصیف شدهاند.
CDG معمولاً با تظاهرات چند سیستمی، معمولاً تاخیر در رشد، عدم رشد، هیپوتونی، ناهنجاریهای عصبی، هپاتوپاتی و انعقاد ظاهر میشود. افراد مبتلا همچنین ممکن است با بیماری های چشمی، پوستی و قلبی و همچنین ناهنجاری های صورت ظاهر شوند. اگرچه تغییرات عصبی و تأخیرهای شناختی در اکثر افراد مبتلا دیده می شود، اما موارد و حتی انواع خاصی وجود دارد که تظاهرات عصبی ندارند. با توجه به علت بالینی و ژنتیکی گسترده CDG، تشخیص بالینی بر شاخص بالایی از سوء ظن در بیماری چند سیستمیک متکی است.
آنالیز ترانسفرین کمبود کربوهیدرات سرم (CDT) اولین آزمایش غربالگری در بیماران مشکوک به CDG است، اما در تشخیص نقص N-گلیکوزیلاسیون با کمبود اسید سیالیک محدود است. آزمایش خط بعدی شامل تجزیه و تحلیل گلیکان مرتبط با دولیکول و آزمایش ژنتیکی است. تشخیص زودهنگام این گروه از بیماری های با رشد تصاعدی مهم است، زیرا برخی از CDG ها قابل درمان هستند. درمان نقص گلیکوزیلاسیون عمدتاً حمایتی است، اگرچه درمانهای هدفمند برای MPI-CDG، SLC35C1-CDG، PIGM-CDG و PGM1-CDG در دسترس هستند. جزئیات مربوط به این درمانها در بخش «درمانهای هدفمند و پیشآگهی» در زیر آمده است. تمرکز این بررسی بر رایجترین انواع CDG با فنوتیپها یا درمانهای قابل تشخیص خواهد بود و مخاطبان هدف ارائهدهندگان مراقبتهای اولیه هستند.
همهگیرشناسیبخش دیگر
بروز و شیوع همه انواع CDG در مجموع به خوبی ثابت نشده است، اگرچه بیمارانی در سراسر جهان از تقریباً هر قومیتی گزارش شده اند و هر دو جنس به یک اندازه تحت تأثیر قرار می گیرند. شیوع تخمین زده شده در جمعیت اروپایی و آفریقایی آمریکایی ۱/۱۰۰۰۰ بر اساس فراوانی ناقل انواع بیماریزای شناخته شده در ۵۳ ژن است ( ۱ – ۴ ). شیوع شایع ترین CDG تشخیص داده شده، PMM2-CDG، از ۱/۲۰۰۰۰ در جمعیت هلندی و ۱/۷۷۰۰۰ در استونی بر اساس گزارش های مجزا متغیر است ( ۵ ، ۶ ). تا به امروز، کمتر از ۱۰۰ مورد برای اکثر انواع CDG گزارش شده است.
طبقه بندی و نامگذاری بیوشیمیاییبخش دیگر
به طور کلی، CDG در حال حاضر به چهار دسته طبقهبندی میشود: (I) گلیکوزیلاسیون N-linked، (II) گلیکوزیلاسیون O-link، (III) N- و O-linked / گلیکوزیلاسیون چندگانه، و (IV) لیپید و گلیکوزیل فسفاتیدیللینوزیتول (GPI). نقص بیوسنتز لنگر
نقص گلیکوزیلاسیون پروتئین مرتبط با N PMM2-CDG، که قبلاً به عنوان CDG نوع Ia شناخته می شد، اولین CDG بود که توسط Jaeken در سال ۱۹۸۰ گزارش شد و تا به امروز رایج ترین CDG باقی مانده است (۷ ) . PMM2-CDG در ابتدا «سندرم گلیکوپروتئین کمبود کربوهیدرات» نامیده شد که به دلیل ناهنجاری های متعدد گلیکوپروتئین سرم که با تمرکز ایزوالکتریک ترانسفرین سرم در افراد مبتلا مشاهده می شود. از لحاظ تاریخی، CDG با الگوهای تحلیل ایزوفرم ترانسفرین طبقهبندی میشد – الگوهای نوع I به مونتاژ گلیکان مرتبط با دولیکول و نقصهای انتقال محلی در سیتوپلاسم یا ER، و الگوهای نوع II به نقصهای پردازش در دستگاه گلژی نسبت داده میشدند. از این نقطه انشعاب، CDGها به ترتیب کشف بر اساس حروف الفبا نامگذاری شدند.
با ظهور گسترده تشخیص های مولکولی، نام گذاری CDG در سال ۲۰۰۸ به روز شد تا علت مولکولی بیماری را مشخص کند، که منعکس کننده رشد تصاعدی مسیرها و اختلالاتی است که به طور منظم در دسته بندی های دوگانه قبلی تطبیق نمی کردند. در حال حاضر، نامگذاری CDG با نام ژن آسیبدیده (غیر مورب، نامهای ژن در www.genenames.org )، و به دنبال آن -CDG (مثلا PMM2-CDG) مشخص میشود ( ۸ ).
ژنتیکبخش دیگر
اکثریت قریب به اتفاق اختلالات مادرزادی گلیکوزیلاسیون به روش اتوزومال مغلوب به ارث می رسند و یک جهش از هر والدین بدون علامت (ناقل) به ارث می رسد. آزمایش مولکولی، معمولاً با روشهای توالییابی نسل بعدی، برای ایجاد تشخیص ژنتیکی ضروری است. آزمایش والدین برای نوع شناخته شده می تواند وراثت را در مقابل وقوع جدید تأیید کند . برای وراثت اتوزومال مغلوب، خطر عود برای خواهر و برادر و هر حاملگی یک فرد مبتلا ۲۵٪ برای مبتلا شدن، ۵۰٪ برای حامل بدون علامت و ۲۵٪ برای عدم ابتلا است.
تعداد انگشت شماری از CDG دارای توارث اتوزومال غالب هستند (N-linked: GANAB-CDG، PRKCSH-CDG؛ O-linked: EXT1/EXT2-CDG، POFUT1-CDG، POGLUT1-CDG). تعداد کمتری به X مرتبط هستند (ALG13-CDG، SSR4-CDG، PIGA-CDG، SLC35A2-CDG، ATP6AP1-CDG). اکثر اشکال غالب و برخی از اشکال مرتبط با X CDG به دلیل جهش های de novo هستند . بیماری ها و ژن های خاص در زیر در بخش “پاتوفیزیولوژی” توضیح داده شده است.
داده های جهش برای همه ژن های منتشر شده برای CDG در پایگاه داده جهش ژن انسانی ( http://www.hgmd.cf.ac.uk/ac/index.php ) موجود است. اطلاعات مربوط به انواع ژن های خاص در پایگاه داده تنوع باز لیدن با ابزارهای بیماریزایی سیلیکو ( http://www.lovd.nl/3.0/home ) موجود است. خلاصههای بالینی برای ژنهای خاص را میتوان در وراثت آنلاین مندلی در انسان ( http://www.omim.org/ ) یا در محدوده محدودتر در GeneReviews ( http://www.ncbi.nlm.nih.gov/ ) یافت. کتاب/NBK1116/ ). با توجه به تعداد کم بیماران مبتلا برای اکثر زیرگروه های CDG، ایجاد همبستگی ژنوتیپ- فنوتیپ دشوار است.
پاتوفیزیولوژیبخش دیگر
بیش از ۱۳۰ نوع CDG تا به امروز گزارش شده است ( ۹ ، ۱۰ ). با توجه به حضور همه جا از مسیرهای گلیکوزیلاسیون، CDG در پاتوژنز بیوشیمیایی خود بسیار متنوع است. پروتئین ها و لیپیدهای متعددی (یعنی اسفنگولیپیدها و گلیکولیپیدها) تحت گلیکوزیلاسیون با مونوساکاریدها و/یا الیگوساکاریدها، که مجموعاً گلیکان نامیده می شوند، در بخش های مختلف سلولی قرار می گیرند. مکان های درون سلولی آنها متنوع است، اما بیشتر نقص ها در دستگاه ER یا گلژی رخ می دهد. ویژگی های بالینی و علت ژنتیکی CDG شایع تر بر اساس مسیر در جدول S1 خلاصه شده است .
در میان پروتئینها، گلیکانها با پیوندشان به زنجیره پلیپپتیدی توصیف میشوند – N-گلیکانها به گروه آمید آسپاراژین (Asn) متصل میشوند در حالی که O-گلیکانها به گروه هیدروکسیل سرین یا ترئونین متصل هستند. سنتز N-گلیکان نیاز به ساخت گام به گام قندهای مرتبط با نوکلئوتید در سیتوزول، مونتاژ در شبکه آندوپلاسمی و پردازش در دستگاه گلژی دارد. در مقابل، سنتز O-گلیکان نیاز به مونتاژ اما بدون پردازش دارد، بنابراین نقص O-گلیکوزیلاسیون عمدتا در دستگاه گلژی رخ می دهد.
نقص گلیکوزیلاسیون پروتئین مرتبط با Nبخش دیگر
N-گلیکوزیلاسیون شامل اتصال کووالانسی ساختارهای کربوهیدراتی به گروه آمید زنجیره جانبی باقیماندههای Asn در یک مکان پذیرنده Asn-X-Ser/Thr، انتقال پلی پپتید بستر به شبکه آندوپلاسمی برای بازسازی، و اصلاح بیشتر N است. – زنجیره گلیکان در گلژی ( ۱۱ ، ۱۲ ). نقص در هر نقطه از مسیر سنتز، مونتاژ و پردازش می تواند منجر به بیماری بالینی شود.
PMM2-CDG توسط انواع بیماری زا در ژن فسفومانوموتاز ۲ ( PMM2 ) ایجاد می شود که منجر به کمبود آنزیم PMM2 می شود که تبدیل سیتوزولی مانوز-۶-فسفات به مانوز-۱-فسفات را در مرحله دوم گوانوزین دی فسفات (GDP) کاتالیز می کند . ) سنتز مانوز. اکثر بیماران دارای جهش های نادرست بیماریزای ترکیبی هتروزیگوت هستند ( www.lovd.nl/PMM2 ). رایج ترین نوع بیماریزای عود کننده p.Arg141His تقریباً در ۴۰ درصد افراد مبتلا از اصل و نسب اروپایی یافت می شود و p.Phe119Leu نیز اغلب در شمال اروپا یافت می شود ( ۱ ). همبستگی ژنوتیپ-فنوتیپ برای PMM2-CDG گزارش شده است ( ۳ ، ۱۳ ، ۱۴ ).
MPI-CDG یک اختلال اتوزومال مغلوب است که توسط انواع بیماری زا در ژن مانوز فسفات ایزومراز ( MPI ) ایجاد می شود که منجر به کمبود فسفومانوز ایزومراز (MPI) می شود. MPI معمولاً اولین مرحله سنتز GDP-مانوز (یعنی تبدیل فروکتوز-۶-فسفات به مانوز-۶-فسفات) را کاتالیز می کند، اما فروکتوز-۶-فسفات در داخل سلولی تجمع نمی یابد زیرا می تواند توسط مسیر گلیکولیتیک نیز متابولیزه شود. . بنابراین، اگرچه از نظر بیوشیمیایی شبیه PMM2-CDG است، اما MPI-CDG درگیری عصبی و چند سیستمی قابل توجهی ایجاد نمی کند. CDT همچنین تست غربالگری انتخابی برای MPI-CDG است که الگوی نوع ۱ را نشان می دهد. سپس تشخیص را می توان به صورت مولکولی یا با فعالیت MPI فیبروبلاست/لکوسیت تایید کرد.
ALG6-CDG یک بیماری مغلوب ناشی از جهش در ALG6 است که منجر به اتصال غیر طبیعی سه مولکول گلوکز به واسطه های مانوز مرتبط با دولیکول و هیپوگلیکوزیلاسیون پایین دست گلیکوپروتئین های سرم می شود ( ۱۵ ).
نقص گلیکوزیلاسیون O-linked و نقص گلیکوزیلاسیون ترکیبی N و O-linkedبخش دیگر
O-گلیکوزیلاسیون شامل افزودن گام به گام زنجیره های کربوهیدرات به باقی مانده های سرین، ترئونین و هیدروکسی لیزین پروتئین ها توسط گلیکوزیل ترانسفرازها در دستگاه گلژی است ( ۱۶ ). انواع مختلفی از گلیکان های مرتبط با O با بیماری های انسانی مرتبط شده اند که با اولین قند متصل به باقی مانده اسید آمینه [به عنوان مثال، ON-acetylglucosaminyl برای GlcNAc و ON-acetylgalactosaminyl برای N-acetylgalactosamine (GalNAc)] نام گذاری شده است (۱۷ ) .
گلیکوزیلاسیون لیپید و نقص بیوسنتز لنگر GPIبخش دیگر
لنگرهای GPI گلیکولیپیدهایی هستند که تحت مونتاژ متوالی در شبکه آندوپلاسمی و تغییرات در گلژی قرار می گیرند. اختلالات بیوسنتز لنگر GPI به دلیل کمبود آنزیم بر اساس حروف الفبا بر اساس ترتیب کشف نامگذاری می شوند و نه به ترتیب زمانی بر اساس مرحله مونتاژ. پس از سنتز، لنگرهای GPI روی غشاهای پلاسما قرار می گیرند و صدها پروتئین سطح سلول را متصل می کنند و عملکردهای سلولی زیادی را انجام می دهند. بیشتر این بیماری ها به استثنای کمبود PIGA مرتبط با X، اتوزومال مغلوب هستند .
تظاهرات بالینیبخش دیگر
با توجه به حضور همه جانبه مسیرهای گلیکوزیلاسیون، تقریباً هر سیستم اندامی ممکن است در CDG درگیر باشد، اگرچه بیشتر موارد شامل ناهنجاری های عصبی است. برخی از CDG با ایکتیوز تظاهر می کنند، از جمله MPDU1-CDG، DOLK-CDG، SRD5A3-CDG ( شکل ۱ )، و PIGL-CDG ( ۱۸ ، ۱۹) .). تقریباً همه CDG در چند سال اول زندگی با بیماری چند سیستمی ظاهر می شوند، به جز برخی از آنها فقط یک سیستم اندام را تحت تأثیر قرار می دهند (یعنی شبکیه در DHDDS-CDG؛ اتصال عصبی عضلانی در ALG2-CDG، ALG14-CDG، CFPT1-CDG؛ مغز. در ST3GAL3-CDG، TUSC3-CDG؛ پوست یا ماهیچه اسکلتی در POGLUT1-CDG، POFUT1-CDG؛ غضروف در EXT1/EXT2-CDG؛ کبد در TMEM199-CDG؛ گلبول های قرمز در SEC23B-CDG). سن شروع و شدت آن ممکن است از کشنده نوزادی تا بزرگسالی تقریباً بدون علامت و هر تغییری در این بین متغیر باشد. شایع ترین مجموعه علائم گزارش شده شامل تأخیر رشد، عدم رشد، هیپوتونی، ناهنجاری های عصبی، هیپوگلیسمی و ناهنجاری های متغیر کبد، چشم، پوست، دستگاه گوارش، ایمونولوژیک، اسکلتی و انعقادی است (۱۹ ) .
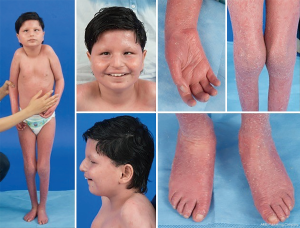
فنوتیپ کامل برای بسیاری از زیرگروه های CDG به دلیل نادر بودن موارد گزارش شده، هنوز کاملا مشخص است. بنابراین، CDG باید در هر محیطی از بیماری چند سیستمیک در نظر گرفته شود، به ویژه در مواردی که دارای یک جزء عصبی یا تاخیر رشد غیراختصاصی با علت نامشخص است.
اگرچه پاتوفیزیولوژی بسیاری از علائم هنوز مشخص نشده است، رابطه بین مسیرهای گلیکوزیلاسیون خاص و علائم بالینی خاص روشن شده است. به عنوان مثال، عدم رشد در بسیاری از انواع CDG به هیپوگلیکوزیلاسیون و ایجاد اختلال در چندین گلیکوپروتئین در مسیر رشد انسولین از جمله IGF-1، ALS و IGFBP-3 نسبت داده می شود (۲۰ ) . همانطور که ما این گروه از اختلالات پیچیده را بهتر درک می کنیم، CDG به طور فزاینده ای در افراد با تشخیص های گریزان شناخته می شود. درگیری سیستم اندام CDG های مختلف در جدول S1 خلاصه شده است . ما ویژگی های بالینی اکثر اشکال و اشکال رایج با درمان های هدفمند CDG را در زیر مورد بحث قرار خواهیم داد.

جدول کامل
نقص گلیکوزیلاسیون پروتئین مرتبط با Nبخش دیگر
به عنوان شایع ترین CDG تشخیص داده شده، فنوتیپ اختلالات گلیکوزیلاسیون مرتبط با N اغلب به عنوان تظاهرات کلاسیک اعلام می شود. با این حال، طیف فنوتیپی CDG کاملاً متنوع است و بسیاری از CDG ممکن است با علائم کلیشهای مرتبط با PMM2-CDG ظاهر نشوند.
PMM2-CDG (کمبود CDG-Ia، PMM2)
PMM2-CDG رایج ترین CDG است که بیش از ۷۰۰ مورد گزارش شده در سراسر جهان دارد. این بیماری با بیماری شدید چند سیستمی در دوران نوزادی، بیماری عصبی و تاخیر رشد در دوران کودکی و/یا ناتوانی ذهنی پایدار در بزرگسالی مشخص می شود ( ۲۱ و ۲۲ ).
در دوران نوزادی، PMM2-CDG معمولاً اندکی پس از تولد با ناهنجاری های عصبی مانند استرابیسم و حرکات غیر طبیعی چشم، هیپوپلازی مخچه، هیپوتونی، عقب ماندگی روانی حرکتی، آتاکسی، هیپوتونی و هیپورفلکسی تظاهر می کند. همچنین ممکن است نوزادان مبتلا به بیماری کبدی، سندرم نفروتیک و کیستهای کلیوی، افیوژن پریکارد و کاردیومیوپاتی هیپرتروفیک، نارسایی رشد و نارسایی چند عضوی باشند که منجر به مرگ در سال اول زندگی در ۲۰ درصد افراد مبتلا میشود ( ۲۱ ، ۲۳ – ۲۸ ).
مجموعه ای از ویژگی های بدشکلی در بیماران مبتلا به PMM2-CDG توصیف شده است ( شکل های ۲،۳). اینها شامل مخچه هیپوپلاستیک، بدشکلی های صورت (به عنوان مثال، گوش های بزرگ و دیسپلاستیک)، نوک سینه های معکوس، و توزیع غیر طبیعی بافت چربی روی باسن یا ناحیه فوق شرمگاهی است که ممکن است با افزایش سن برطرف شود ( ۱۴ ، ۲۱ ، ۲۹-۳۲ ) . توصیف شده است که بیماران رفتاری برونگرا و شاد دارند. تظاهر بسیار متغیر است، اگرچه استرابیسم در بیش از ۷۰ درصد بیماران مبتلا دیده می شود ( ۲۱ ، ۲۳ ، ۳۳-۳۵ ). نوک سینه های معکوس و پدهای چربی غیر طبیعی در حدود ۲۵ تا ۵۰ درصد بیماران دیده می شود ( ۳۶ ).

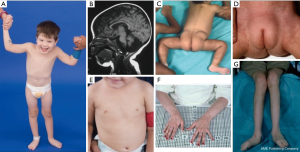
در دوران کودکی، افراد مبتلا ممکن است به رتینیت پیگمانتوزا، حملات و تشنجهای مشابه سکته، تاخیر گفتاری و حرکتی و نوروپاتی محیطی مبتلا شوند. طبق قانون اساسی، بیماران معمولاً به دلیل تغذیه و ناهنجاری های گوارشی و تاخیر در رشد جهانی، رشد نمی کنند. افزایش ترانس آمینازهای کبدی بدون عواقب بالینی ممکن است مشاهده شود که معمولاً تا ۵ سالگی با نوسانات گاه به گاه همراه با بیماری عادی می شود ( ۲۱ ، ۲۴ ). بیوپسی کبد به ندرت در CDG اندیکاسیون می شود مگر اینکه به فیبروز کبدی مشکوک باشد ( ۱ ). کم کاری تیروئید بالینی نادر است، اما بیماران مبتلا به CDG باید هورمون های تیروئید و T4 آزاد خود را اندازه گیری کنند، که ممکن است گلوبولین اتصال تیروئید پایین (TBG) و افزایش گذرا در هورمون محرک تیروئید (TSH) را نشان دهد.۳۷ ). ناهنجاری های کبد و مجرای صفراوی در بیماران PMM2-CDG گزارش نشده است.
بزرگسالان مبتلا به PMM2-CDG ممکن است تا دهه هفتم یا هشتم خود با تأخیر شناختی پایدار، نوروپاتی محیطی و کیفوسکولیوز پیشرونده قفسه سینه و نخاع همراه با استئوپنی یا پوکی استخوان زندگی کنند ( ۳۴ ). آتاکسی مخچه یک علامت فزاینده شناخته شده همراه با درگیری چند سیستمی است ( ۳۸-۴۰ ). ناهنجاری های غدد درون ریز از جمله هیپرپرولاکتینمی، ترشح هورمون رشد همراه با هیپرگلیسمی، مقاومت به انسولین و هیپوگلیسمی هیپرانسولینمی ( ۴۱ و ۴۲ ). در زنان مبتلا، هیپوگنادیسم هیپوگنادوتروپیک ممکن است منجر به عدم رشد جنسی ثانویه یا عدم وجود تخمدان شود ( ۴۱ ، ۴۳ ، ۴۴) .). بیماران ممکن است به دلیل کاهش فاکتورهای انعقادی سرم از جمله فاکتورهای IV، IX و XI، آنتی ترومبین III، پروتئین C و پروتئین S در معرض افزایش خطر ترومبوز باشند (۲۹ ) .
MPI-CDG (CDG-Ib، کمبود ایزومراز مانوزفسفات)
MPI-CDG منحصر به فرد است زیرا بیماران مبتلا درگیری عصبی اندکی یا بدون درگیری دارند و برخی از تظاهرات بیماری با مانوز خوراکی قابل درمان هستند ( ۲ ). علائم عمدتاً کبدی- روده ای بدون ویژگی های بدشکلی یا تأخیرهای شناختی هستند. بیماران معمولاً با استفراغ مکرر، هیپوگلیسمی قابل توجه، نارسایی در رشد، آنتروپاتی هدر دهنده پروتئین بالقوه تهدید کننده زندگی، تغییرات فیبروتیک کبد و اتساع مجاری صفراوی مراجعه می کنند ( ۴۵-۵۱ ). بیماران به دلیل غلظت کم پروتئین C و S سرم و آنتی ترومبین III در معرض خطر حوادث ترومبوتیک هستند.
ALG6-CDG (کمبود گلوکوزیل ترانسفراز ۱)
ALG6-CDG دومین نقص شایع N-گلیکوزیلاسیون است که با فنوتیپ مشابه اما خفیف تر از PMM2-CDG مشخص می شود. بیماران مبتلا به ALG6-CDG در رشد، تاخیر در رشد، هیپوتونی، تشنج، استرابیسم، آتاکسی، انعقاد خون، و ناهنجاری های صورت (به عنوان مثال، گوش های پایین، هایپرتلوریسم و ماکروگلوسیا) نارسایی دارند. مشابه MPI-CDG، ممکن است آنتروپاتی از دست دادن پروتئین نیز داشته باشند. علاوه بر این، بیماران مبتلا ممکن است ناهنجاری های اسکلتی از جمله ناهنجاری های براکیداکتیلی و انگشتان و اسکولیوز داشته باشند. بیماران مبتلا به طور معمول دارای رتینیت پیگمانتوزا یا هیپوپلازی مخچه نیستند ( ۵۲ ).
نقص گلیکوزیلاسیون O-linked و نقص گلیکوزیلاسیون ترکیبی N و O-linkedبخش دیگر
به دلیل حضور قابل توجه O-گلیکان ها در پروتئین های حاوی موسین از جمله گلیکوزآمینوگلیکان ها (GAGs) و سطوح اپیتلیال ( ۵۳ )، اختلالات سنتز GAG به طور معمول منجر به دیسپلازی اسکلتی یا بیماری بافت همبند می شود. بیماران مبتلا ممکن است با ناهنجاریهای اسکلتی- عضلانی، پوستی و مفصلی ( مانند شلی مفاصل، اگزوستوزهای متعدد ، کندرو/استئوسارکوم) علاوه بر علائم عصبی ( ۵۴-۵۶ ). به عنوان مثال، N-acetylgalactosaminyltransferase 3 ( GALNT3 ) O-گلیکوزیله هورمون فسفاتوریک، FGF23، جلوگیری از برش پروتئولیتیک و اجازه ترشح دست نخورده آن. کمبود GALNT3 منجر به کلسینوز تومورال خانوادگی می شود که با هیپرفسفاتمی و کلسیفیکاسیون نابجا مشخص می شود.۵۷ ، ۵۸ ).
گلیکوزیلاسیون لیپید و نقص بیوسنتز لنگر GPIبخش دیگر
گلیکوسفنگولیپیدها و مشتقات سیالیله آنها، گانگلیوزیدها، عمدتاً توسط نورون ها بیان می شوند. نقص در تجزیه گانگلیوزیدها منجر به تجمع و بیماری های ذخیره سازی لیزوزومی با مشخصه خوب می شود. در نقطه مقابل، نقص در بیوسنتز گانگلیوزید مانند ST3GAL5-CDG و B4GALNT1-CDG بسیار نادر است و منجر به بیماری های عصبی شدید می شود. بیماران ممکن است با پاراپلژی اسپاستیک، تاخیر ذهنی شدید، صرع و علائم غیر عصبی از جمله دیسپلازی اسکلتی، ویژگی های بدشکلی و رنگدانه های غیر طبیعی پوست مراجعه کنند ( ۵۹ ، ۶۰ ).
جهش در بسیاری از ژن ها در مسیر بیوسنتزی لنگر GPI باعث انواع ناهنجاری های مادرزادی، ناتوانی ذهنی و صرع می شود. بهترین نقص بیوسنتز GPI، کمبود PIGA مرتبط با X، با اسپاسم نوزادی همراه با هیپساریتمی، هیپوتونی، ناهنجاری های متعدد مغزی و بدشکلی های صورت خود را نشان می دهد. بیماران همچنین ممکن است پوست، کبد، قلب و بیماری های کلیوی متغیر داشته باشند ( ۶۱-۶۹ ) . برخی جهشهای درون PIGA باعث بیماری متمایز از نظر فنوتیپی هموگلوبینوری حملهای شبانه (PNH)، یک اختلال اکتسابی نارسایی مغز استخوان میشوند ( ۷۰ ، ۷۱ ).
تشخیصبخش دیگر
هنگامی که یک CDG مشکوک بالینی باشد، اولین گام درخواست آزمایش بیوشیمیایی CDG در پلاسما یا سرم، از جمله آزمایش CDT و N-گلیکان است. آنالیز CDT و N-گلیکان سرم فقط می تواند نقص های N-گلیکوزیلاسیون را تشخیص دهد، بنابراین در افتراق عیوب O-glycosylation یا GPI لنگر مفید نیستند. تجزیه و تحلیل ایزوفرم ترانسفرین در اصل با تمرکز ایزوالکتریک ترانسفرین به دست آمد، زیرا شکست سنتز N-گلیکان باعث کمبود جزئی اسید سیالیک می شود که بار ترانسفرین سرم و متعاقباً مهاجرت کاتدی آن را در میدان الکتروفورتیک تغییر می دهد. با این حال، تجزیه و تحلیل مبتنی بر طیف سنجی جرمی ترانسفرین و N-گلیکان در حال حاضر تا حد زیادی جایگزین تمرکز ایزوالکتریک با شناسایی تغییرات خاص در الیگوساکاریدها بر حسب جرم و بار شده است ( ۷۲ ).
نقص گلیکوزیلاسیون پروتئین مرتبط با Nبخش دیگر
نتایج CDT ترانسفرین سرم به صورت نسبت مونوالیگوساکارید/دی-الیگوساکارید ترانسفرین، ترانسفرین a-الیگوساکارید/دی-الیگوساکارید، ترانسفرین تری سیالو/دی-الیگوساکارید، آپولیپوپروتئین CIII-1/ آپولیپوپروتئین CIII-2، و آپولیپوپروتئین CIII-2 و CI گزارش شده است. -۰/نسبت CIII-2 آپولیپوپروتئین. این نتایج کمی با تفسیر الگوی یافتهها نیز همراه خواهد بود.
یک CDT ترانسفرین الگوی نوع I با افزایش باندهای دی و آسیالوترانسفرین مشخص می شود و نشان دهنده نقص در سنتز N-گلیکان در سیتوزول یا شبکه آندوپلاسمی است. یک الگوی نوع II با افزایش باندهای دی و آسیالوترانسفرین و باندهای تری و/یا مونوسیالوترانسفرین مشخص می شود و نشان دهنده نقص در پردازش N-گلیکان در دستگاه گلژی است (۷۳ ) .
اگر یک الگوی CDT ترانسفرین سرم نوع I تشخیص داده شود، کمبود PMM2 یا کمبود MPI باید در خط مقدم تفاوت باشد، زیرا PMM2-CDG رایج ترین CDG است و MPI-CDG قابل درمان است و در صورت عدم درمان به طور بالقوه کشنده است. برای تمایز بین تشخیص ها، پروفایل N-گلیکان، تعیین توالی مولکولی یا آزمایش آنزیمی باید انجام شود. تشخیص PMM2-CDG یا MPI-CDG از طریق آزمایش مولکولی که انواع بیماریزای دو آللی را در PMM2 یا MPI نشان میدهد، به دنبال آن فعالیت آنزیم PMM یا MPI در لکوسیتها یا فیبروبلاستها در صورتی که بیماریزایی واریانتهای ژنتیکی نامشخص باشد، تأیید میشود. تجزیه و تحلیل N-گلیکان یا آنالیز مولکولی اکثریت ALG-CDG را از PMM2 یا MPI-CDG متمایز می کند ( ۱۵ ).
یک الگوی CDT ترانسفرین سرم نوع II نشان دهنده نقایص گلژی مانند کمبود N-acetylglucosaminyltransferase (GnT) II (CDG type IIA، MGAT2-CDG) است. تجزیه و تحلیل ایزوفرم آپولیپوپروتئین CIII (Apo-CIII) یک آزمایش مکمل برای پروفایل CDT نوع II است، زیرا نقص های O-گلیکوزیلاسیون موسین را در دستگاه گلژی اندازه گیری می کند. حساسیت محدودی برای CDT یا Apo-CIII در تشخیص CDG نوع II وجود دارد. بنابراین پروفایل N-گلیکان و O-گلیکان و پانل مولکولی یا توالی یابی اگزوم باید زمانی انجام شود که این آزمایشات بالینی در دسترس باشد. الگوهای گلیکوزیلاسیون ترانسفرین ممکن است به طور پراکنده عادی شود. بنابراین، آزمایش مکرر ممکن است در بیماران با شاخص شک بالا نشان داده شود. ممکن است در بیماران مبتلا به بحران حاد عدم تحمل فروکتوز ارثی، گالاکتوزمی، بیماری حاد کبدی و برخی عفونت های باکتریایی، نتایج مثبت کاذب به دست آید. هیچ یک از آزمایشهای بیوشیمیایی CDG نمیتواند همه CDGها را غربال کند، بنابراین حتی در صورت وجود نتایج غربالگری طبیعی، آزمایش پانل ژن مولکولی یا توالییابی اگزوم ممکن است برای شک بالینی قوی انجام شود. برعکس، تأیید بیوشیمیایی و عملکردی یافتههای ژنتیکی مولکولی نیز ضروری است، زیرا اکثر بیماران مبتلا به CDG حداقل یک جهش خفیف و اغلب نادرست جدید را حمل میکنند.
نقص گلیکوزیلاسیون O-linked و نقص گلیکوزیلاسیون ترکیبی N و O-linkedبخش دیگر
تشخیص متکی بر توالی یابی مولکولی است، زیرا آنالیز ایزوفرم ترانسفرین نقایص O-گلیکوزیلاسیون مجزا را تشخیص نمی دهد. نقایص گلیکوزیلاسیون مرتبط با N و O را می توان با آنالیز CDT، ApoCIII و آنالیز N-گلیکان و O-گلیکان پلاسما شناسایی کرد.
گلیکوزیلاسیون لیپید و نقص بیوسنتز لنگر GPIبخش دیگر
فلوسیتومتری گرانولوسیت های خون بیان سطح سلولی پروتئین های لنگردار GPI مانند CD16 و CD24 را اندازه گیری می کند. آنالیز فلوسیتومتری گلبولهای سفید یا گلبولهای قرمز خون برای پروتئینهای سطح سلولی خاص GPI بهعنوان آزمایشی برای PNH به دلیل جهشهای اکتسابی در ژن PIGA در دسترس است . آزمایش PNH ممکن است ناهنجاریهایی را در سایر نقصهای لنگر GPI نشان دهد، اما تشخیص بیشتر به تجزیه و تحلیل مولکولی بستگی دارد.
آنالیز مولکولیبخش دیگر
بالاترین بازده تشخیصی برای CDG، پانل توالی یابی ژن مبتنی بر نسل بعدی یا توالی یابی اگزوم بالینی (CES) است. توالی یابی ژنتیکی توالی نوکلئوتیدی یا املای “حروف” ژن ها را تصحیح می کند تا مشخص کند آیا تغییری وجود دارد که بر عملکرد ژن تأثیر می گذارد یا خیر. ژنوم انسان از ۳ میلیون نوکلئوتید تشکیل شده است اما تنها ۱ تا ۲ درصد از این نوکلئوتیدها که اگزون نامیده می شوند به یک محصول پروتئینی کاربردی ترجمه می شوند. DNA غیر کدکننده باقیمانده که بین اگزون هایی که ترجمه نمی شوند پراکنده شده اند، اینترون نامیده می شوند ( ۷۴) .). CES تقریباً تمام اگزونهای شناخته شده از حدود ۲۰۰۰۰ ژن در ژنوم انسان را بررسی میکند، که اقلیتی از مواد ژنتیکی در کروموزومها را تشکیل میدهند، اما به احتمال زیاد دارای انواع بیماریزا (بیماریزا) هستند. CES همچنین میتواند شامل توالییابی DNA میتوکندری (mtDNA) باشد که DNA دایرهای کوچک، خارج هستهای واقع در میتوکندری را که منحصراً از طریق مادر به ارث رسیده است، بررسی میکند.
نتایج ممکن برای CES شامل مثبت، منفی و انواع با اهمیت ناشناخته است. نتیجه مثبت به این معنی است که انواع شناخته شده بیماری زا (یعنی بیماری زا) شناسایی می شوند، پس از آن می توان تشخیص، تاریخچه طبیعی، پیش آگهی، خطر عود و گزینه های درمانی را مورد بحث قرار داد. یک نتیجه منفی به این معنی است که هیچ گونه بیماری زا قابل تشخیصی شناسایی نشد. انواع با اهمیت ناشناخته (با نام مستعار، VUS) به این معنی است که اگرچه تغییرات ژنتیکی شناسایی شده است، اطلاعات کافی در مورد تغییر ژنتیکی خاص وجود ندارد تا به طور قطعی بدانیم که آیا باعث بیماری است یا خیر. تغییرات در DNA هر فرد مورد انتظار است، بنابراین آزمایش همزمان نمونه های والدین برای مقایسه می تواند به تفسیر آزمایشگاهی و بالینی نتایج کمک کند.۷۵ – ۷۷ ). CES به طور فزاینده ای به عنوان اولین آزمایش ژنتیکی گسترده انتخابی با توجه به زمان چرخش سریع و هزینه نسبی کم آن برای مقدار اطلاعات ژنتیکی تجزیه و تحلیل شده سفارش داده می شود. محدودیتهای CES شامل فقدان حساسیت ۱۰۰٪، ناتوانی در تشخیص انواع خاصی از تغییرات ژنتیکی (مانند حذف، تکرار، تکرارهای سه نوکلئوتیدی، جهشهای عمیق اینترونیک یا نقص متیلاسیون) و این واقعیت است که تشخیص ممکن است اضافی را ارائه نکند. اطلاعات در مورد بیماری یا تغییر مدیریت
در گزارش CES، واریانت های بیماریزای تصادفی در ژن های مرتبط با شرایط ژنتیکی شناخته شده ممکن است به عنوان یافته های ثانویه گزارش شوند ( ۷۸ ). این لیست از بیماری های توصیه شده توسط کالج آمریکایی ژنتیک پزشکی (ACMG) تهیه شده است. قانون عدم تبعیض اطلاعات ژنتیکی (GINA) در هنگام تصمیم گیری در مورد انتخاب یا عدم یادگیری یافته های تصادفی، ملاحظات مهمی است ( ۷۹ ). GINA از افراد در برابر سوء استفاده از اطلاعات ژنتیکی در بیمه درمانی و اشتغال محافظت می کند، اما بیمه عمر را محافظت نمی کند. GINA از اطلاعات ژنتیکی زیر محافظت می کند: سابقه پزشکی خانوادگی، آزمایش حامل، آزمایش ژنتیکی قبل از تولد، تست حساسیت و پیش بینی، و تجزیه و تحلیل تومورها یا سایر ارزیابی های ژن، جهش یا تغییرات کروموزومی.
مدیریتبخش دیگر
مدیریت CDG تا حد زیادی به علائم خاص فرد بستگی دارد. علائم عود کننده در بیماران مبتلا به CDG شامل ناتوانی در رشد، تاخیر رشد کلی، استفراغ، سکته های مغزی مانند و ناهنجاری های اسکلتی است. انعقاد بالینی یا تحت بالینی، اندوکرینوپاتی، هپاتوپاتی و نقایص قلبی نیز معمولاً دیده می شود. آزمایشهای آزمایشگاهی پایه برای تعیین وسعت بیماری و نظارت معمول، بهویژه برای PMM2-CDG توصیه میشود. اینها شامل تست های عملکرد کبد، آلبومین سرم، تست های عملکرد تیروئید شامل T4 آزاد، پروتئین C، پروتئین S، آنتی ترومبین III، فاکتور IX، آنالیز ادرار و گنادوتروپین سرم و هورمون رشد می باشد.
تصویربرداری توصیه شده شامل اکوکاردیوگرام، سونوگرافی کلیه، سن استخوان، معاینه چشم پزشکی برای ارزیابی عدسی، شبکیه، تحرک چشم و فشار داخل چشم است. واکسیناسیون معمول برای بزرگسالان و کودکان مبتلا به CDG توصیه می شود، مگر اینکه خلاف آن مشخص شده باشد. تیتر آنتی بادی باید پس از واکسیناسیون به دست آید زیرا ممکن است بیماران پاسخ ایمنی زایی کمتر از حد مطلوب داشته باشند. در صورت وجود کمبود در ابتدا، ممکن است پر کردن پیشگیرانه فاکتورهای انعقادی قبل از هر عمل جراحی ضروری باشد.
ارزیابی ژنتیک بالینی باید برای بحث در مورد جنبه های ارثی CDG و همچنین ایجاد یک خانه پزشکی برای این بیماران پیچیده انجام شود. خانه پزشکی معمولاً خدمات ژنتیک بیوشیمیایی است، اگرچه بخشهای ژنتیک، رشد عصبی، یا عصبشناسی نیز در این ظرفیت خدمت میکنند، اگر خدمات اختصاصی ژنتیک بیوشیمیایی در دسترس نباشد. ارجاع متخصص برای گوارش، هماتولوژی، غدد درون ریز، حمایت تغذیه، گفتار، درمان های شغلی، فیزیکی و تغذیه، ارتوپدی و پزشکی توانبخشی اغلب ضروری است.
درمان های هدفمند و پیش آگهیبخش دیگر
درمان اکثر انواع CDG به جز چند استثنا عمدتاً حمایتی است. MPI-CDG به طور مؤثر در بین همه CDG قابل درمان است. مانوز خوراکی توسط هگزوکینازهای داخل سلولی به مانوز-۶-فسفات تبدیل میشود، بنابراین بلوک آنزیمی را دور زده و سوبسترای کمبود تولید میکند. مکمل مانوز معمولاً با ۱ گرم بر کیلوگرم وزن بدن در روز شروع می شود که به ۴ تا ۶ دوز در روز تقسیم می شود. در حالی که آنتروپاتی هدر دهنده پروتئین بالقوه تهدید کننده زندگی به ویژه به درمان مانوز پاسخ می دهد، بیماری کبدی در MPI-CDG ممکن است به پیشرفت خود ادامه دهد. علائم بالینی به سرعت بهبود مییابد و CDT ترانسفرین طی ماهها عادی میشود، اگرچه بیماری کبد ممکن است با درمان به پیشرفت خود ادامه دهد ( ۴۵ ، ۸۰ ، ۸۱ ).
در مصرف مکمل مانوز در دوران بارداری باید احتیاط کرد، زیرا تجویز مانوز در مدل های موش ایزومراز هیپومورفیک فسفومانوز باردار منجر به مرگ و میر جنینی و کوری در نوزادان آنها شد ( ۸۲ ). علاوه بر این، مانوز داخل وریدی با کاهش هوشیاری و تشنج همراه بوده است که با تجویز گلوکز برطرف شد ( ۸۳ ).
درمان PMM2-CDG تا حد زیادی حمایتی و مبتنی بر علائم است. با این حال، آزمایشهای بالینی آتی روی درمان جایگزینی سوبسترای مانوز-۱-فسفات در حال حاضر در دست توسعه است.
برای سایر CDG، قندهای ساده خوراکی مختلف با هدف بهبود تئوری هیپوگلیکوزیلاسیون بررسی شده است. فوکوز برای SLC35C1-CDG و گالاکتوز برای PGM1-CDG و SLC35A2-CDG با نتایج مختلط آزمایش شده است ( ۸۴ ). D-گالاکتوز با ۱٫۰-۲٫۵ گرم بر کیلوگرم در روز (حداکثر ۵۰ گرم) برای بهبود هیپوگلیسمی، انعقاد و غدد درون ریز در PGM1-CDG نشان داده شده است ( ۸۵ ، ۸۶ ). همچنین نشان داده شده است که گالاکتوز باعث بهبود اندوکرینوپاتی و انعقاد در TMEM165-CDG ( ۸۷ ) و SLC39A8-CDG می شود. همچنین بهبود بالینی قابل توجهی در بیماران SLC39A8-CDG با mg/kg/day 15-20 MnSO4 گزارش شد ( ۸۸) .). کارآزماییهای بالینی برای بررسی کاربرد N-acetylmannosamine (ManNAc) در GNE-CDG ( ۸۹ )، و چندین کارآزمایی پیش بالینی برای CDG دیگر در حال انجام است ( ۹۰ ).
با وجود پیشرفت های پزشکی، مرگ و میر قابل توجهی برای کودکان مبتلا به CDG در سال اول زندگی ناشی از نارسایی چند عضوی یا عفونت شدید وجود دارد ( ۹۱ ). نوزادان مبتلا به CDG ممکن است با بیماری چند اندامی برق آسا، تشنجهای غیرقابل درمان یا هیپوآلبومینمی شدید در حال پیشرفت به آنسارکا مراجعه کنند. برخی از بیماران به دیورز تهاجمی و جایگزینی آلبومین پاسخ می دهند در حالی که برخی دیگر به درمان انکساری می کنند. نشان داده شده است که سدیم بوتیرات کنترل تشنج را در CAD-CDG و PIGM-CDG بهبود می بخشد ( ۹۲ ). همچنین نشان داده شده است که رژیم کتوژنیک در برخی موارد PIGA-CDG فراوانی تشنج را کاهش می دهد ( ۹۳)). در طول دوره های سکته مانند، هیدراتاسیون داخل وریدی و حفظ قند خون طبیعی ممکن است مفید باشد در حالی که علت ترومبوتیک عروقی یا خونریزی رد شده است.
با ظهور تکنیک های ویرایش ژنوم و درک بهتر مکانیسم بیماری های تحت پوشش تشخیصی CDG، آینده توسعه درمانی هدفمند امیدوارکننده است.
اختلال مادرزادی گلیکوزیلاسیون نوع Ia چیست؟
اختلال مادرزادی گلیکوزیلاسیون نوع Ia (CDG-Ia) یک اختلال متابولیک ارثی است که تولید گلیکوپروتئینها را که پروتئینهایی هستند که کربوهیدراتهای متصل دارند، مختل میکند. در CDG-Ia، نقص در آنزیمی به نام فسفومانوموتاز وجود دارد.
CDG-Ia بر بسیاری از سیستم های بدن، به ویژه سیستم عصبی تاثیر می گذارد. این بیماری باعث تاخیر در رشد می شود که می تواند منجر به ناتوانی ذهنی شود. همچنین می تواند باعث تشنج و دوره های سکته مغزی شود. هم توانایی حرکت فیزیکی و هم توانایی هماهنگ کردن آن حرکت را مختل می کند. تقریباً ۲۰ درصد از نوزادان مبتلا به این بیماری در سال اول زندگی می میرند. اکثر افراد مبتلا به CDG-Ia ویلچر خواهند بود.
یک فرد مبتلا به CDG-Ia ممکن است برخی یا همه علائم زیر را نشان دهد: عدم رشد با سرعت طبیعی. نوع خاصی از دید محدود که منجر به کوری می شود (رتینیت پیگمانتوزا). تیروئید کم کار (کم کاری تیروئید)؛ بزرگ شدن کبد و/یا بیماری کبدی؛ مشکلات قلبی و کلیوی؛ قند خون پایین؛ کاهش توانایی لخته شدن خون پس از آسیب؛ پوست ضخیم، متورم، حفره دار (پودورنجی)؛ و ناهنجاری های استخوانی برخی از افراد بسیاری از علائم فوق را دارند در حالی که برخی دیگر علائم کمی دارند.
در افراد مبتلا به CDG-Ia، ویژگیهای مشخصی در بدو تولد آشکار میشود. اینها ممکن است شامل نوک سینه های معکوس، تون عضلانی ضعیف، چشم های ضربدری شکل بادام، پیشانی بزرگ، توزیع غیرعادی چربی بدن و اندام تناسلی غیر طبیعی باشد. بخشی از مغز که مخچه نامیده می شود اغلب تا حدی از بین می رود. زنان مبتلا به این بیماری اغلب به رشد جنسی نمی رسند.
اختلال مادرزادی گلیکوزیلاسیون نوع Ia چقدر شایع است؟
CDG-Ia 70 درصد از اختلالات مادرزادی گلیکوزیلاسیون را تشکیل می دهد که در مجموع ۱ مورد از هر ۵۰۰۰۰ تا ۱۰۰۰۰۰ تولد را تحت تأثیر قرار می دهد. موارد CDG-Ia در سراسر جهان گزارش شده است که حدود نیمی از آنها از کشورهای اسکاندیناوی بوده است.
اختلال مادرزادی گلیکوزیلاسیون نوع Ia چگونه درمان می شود؟
هیچ درمانی برای CDG-Ia وجود ندارد، با این حال ممکن است برخی اقدامات برای بهبود زندگی افراد مبتلا به این بیماری انجام شود. والدین یک کودک خردسال مبتلا به CDG-Ia باید اطمینان حاصل کنند که کودک بهترین تغذیه ممکن را برای کمک به رشد دریافت می کند. برخی از کودکان به لوله تغذیه نیاز دارند. استفاده زودهنگام از درمان های شغلی، فیزیکی و گفتار درمانی ممکن است در بهبود توانایی های طولانی مدت کودک در این زمینه ها مفید باشد. اقدامات جراحی یا غیرجراحی ممکن است چشم های ضربدری را اصلاح کند و دید بهتر را تضمین کند. تزریق پلاسمای خون ممکن است قبل از جراحی برای کمک به لخته شدن ضروری باشد. داروها ممکن است به کنترل تشنج کمک کنند. اگر فرد غده تیروئید کم کار داشته باشد، هورمون های مختلف ممکن است مفید باشند. ویلچر و سایر وسایل کمک حرکتی نیز اغلب مفید هستند.
پیش آگهی برای یک فرد مبتلا به اختلال مادرزادی گلیکوزیلاسیون نوع Ia چیست؟
۲۰ درصد از افراد مبتلا به CDG-Ia در سال اول زندگی می میرند که اغلب به دلیل عفونت، مشکلات کبدی یا بیماری قلبی است. سایر مبتلایان به CDG-Ia ممکن است تا بزرگسالی زندگی کنند. اکثر آنها در طول زندگی خود ویلچر بسته شده اند. برخی قادر به صحبت کردن و مکالمه هستند، البته با برخی اختلالات. افراد مبتلا به CDG-Ia قادر به زندگی مستقل نیستند، اما ممکن است وظایف خاصی را به طور مستقل انجام دهند.
نام های دیگر برای
اختلال مادرزادی گلیکوزیلاسیون نوع Ia
- CDG-Ia
- CDG1a
- CDGS1a
- سندرم گلیکوپروتئین کمبود کربوهیدرات، نوع ۱A
- سندرم گلیکوپروتئین کمبود کربوهیدرات، نوع Ia
- اختلال مادرزادی گلیکوزیلاسیون Ia
- اختلال مادرزادی گلیکوزیلاسیون ۱a
- کمبود فسفومانوموتاز ۲